Nach der Lektüre dieses DFP-Literaturstudiums kennen Sie die wichtigsten medikamentösen und sonstigen Therapiemodalitäten für Patienten mit Herzinsuffizienz. Sie sind sich der Problematik der Polypharmazie gerade bei Herzinsuffizienz bewusst und wissen, worauf in der Medikation bei Herzinsuffizienz speziell zu achten ist.
Primäre Zielgruppen: Ärztinnen und Ärzte für Allgemeinmedizin bzw. innere Medizin, die Personen mit Herzinsuffizienz behandeln
Behandlung und Betreuung von Herzinsuffizienzpatienten
Epidemiologie und Definitionen
Die Prävalenz der Herzinsuffizienz (HI) nimmt mit steigendem Alter stark zu: Bei Menschen ab 80 Jahren sind fast 15% der Männer und mehr als 10% der Frauen betroffen. Pathophysiologisch lässt sich zwischen einer Störung der Pumpfunktion („Entleerungsstörung“) und einer Störung der Ventrikelfüllung unterscheiden. Die frühere Unterscheidung zwischen einer „systolischen“ und einer „diastolischen“ HI ist mittlerweile verlassen. Man spricht heute von Herzinsuffizienz mit reduzierter Auswurffraktion („Heart Failure with reduced Ejection Fraction“ – HFrEF) und Herzinsuffizienz mit erhaltener Auswurffraktion („Heart Failure with preserved Ejection Fraction“ – HFpEF).
Zu den wichtigsten Risikofaktoren für die Atherosklerose und -thrombose und somit zu den via koronare Herzkrankheit und Myokardinfarkt häufigsten Ätiologien einer HI zählen Rauchen, Dyslipidämie, Hypertonie, Diabetes mellitus, Adipositas und Bewegungsmangel. Hypertonie und Klappenvitien (Stenosen der Taschenklappen) können eine ventrikuläre Hypertrophie verursachen, Volumsbelastungen führen zu einer kardialen Dilatation. Dies sind Mechanismen des kardialen Remodelling, welche konsekutiv zu HI führen.
Von einer HI spricht man dann, wenn zu den objektivierbaren Befunden im Sinne einer systolischen und/oder diastolischen Dysfunktion beziehungsweise des Remodellings auch klinische Symptome kommen. Abbildung 1 zeigt das sogenannte kardiovaskuläre Kontinuum, das die stufenweise Entwicklung vom Auftreten von kardiovaskulären Risikofaktoren bis zur chronischen HI darstellt.

Abb. 1: Das kardiovaskuläre Kontinuum
Pathophysiologie
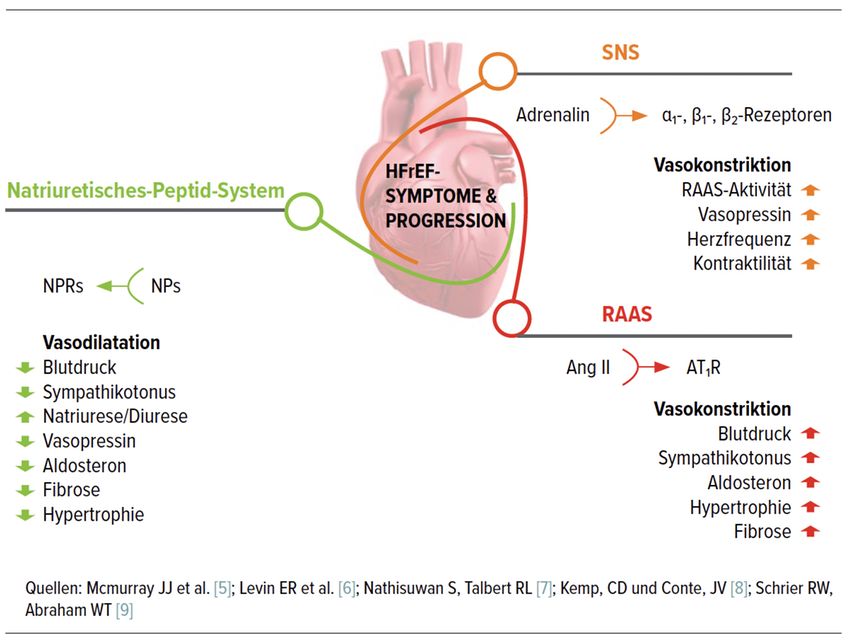
Pathophysiologisch kommt es bei HFrEF durch intrakardiale Druck- und/oder Volumsänderungen zu einer erhöhten Wandspannung bzw. bei reduzierter Auswurfleistung zu einer Abnahme des Herzminutenvolumens. Dies bedingt eine systemische neurohumorale Aktivierung, aufgrund der anhaltenden Triggerung ist diese chronisch. Abbildung 2 zeigt die wesentlichen Komponenten der neurohumoralen Aktivierung – das Natriuretisches-Peptid-System, das adrenerge/sympathische Nervensystem (SNS) und das Renin-Angiotensin-Aldosteron-System (RAAS). Folgen der chronischen Überaktivierung von SNS und RAAS sind Vasokonstriktion, Hypertrophie des Myokards mit zahlreichen Veränderungen auf zellulärer und molekularer Ebene, Myotoxizität und daher Fibrose bzw. Apoptose. Dies wiederum führt zu einem maladaptiven Remodelling mit progredienter Verschlechterung der linksventrikulären Pumpfunktion sowie zu hämodynamischen Veränderungen mit Salz- und Wasserretention. Daraus resultieren typische HI-Symptome wie Dyspnoe, Ödeme und Abgeschlagenheit. Durch Arrhythmien und reduzierte linksventrikuläre Auswurffraktion (LVEF) steigen Morbidität und Mortalität.[2–4]
Natriuretische Peptide haben eine gegenteilige – und daher in diesem Fall protektive – Wirkung; sie bewirken unter anderem eine Vasodilatation sowie gesteigerte Natriurese und Diurese.
Allerdings überwiegen bei HI im Nettoeffekt die bei chronischer Aktivierung von SNS und RAAS ungünstigen Auswirkungen die günstige Wirkung der Aktivierung von natriuretischen Peptiden klar.
Aus dem in Abbildung 2 dargestellten Modell lassen sich auch die wichtigsten medikamentösen Therapiemodalitäten ableiten: Betablocker wirken gegen die Überaktivierung des Sympathikus, während ACE-Hemmer, Angiotensin-Rezeptor-Blocker (ARB) und Mineralokortikoid-Rezeptor-Antagonisten (MRA) auf unterschiedliche Aspekte des RAAS wirken und daher summarisch als RAAS-Blocker bezeichnet werden können.
Überlegen Sie: Welches sind die beiden wichtigsten pathophysiologischen Wege bei der Entstehung der HI? An welchem Punkt des kardiovaskulären Kontinuums treffen sie sich?
Die zwei pathophysiologischen Hauptwege der HI-Entstehung sind die koronare Herzkrankheit/der Myokardinfarkt sowie die linksventrikuläre Hypertrophie. Beides führt letztlich zu kardialem Remodelling und damit zu HI.
Mortalität und Prognose
Dass die in Leitlinien empfohlenen Medikamente die HI-Mortalität senken, wurde in zahlreichen Studien nachgewiesen. Obwohl die Kollektive der einzelnen Studien nicht direkt vergleichbar sind und die Beobachtungszeiträume unterschiedlich waren, lässt sich doch sagen, dass ACE-Hemmer die Mortalität bei HFrEF um relative 16% senkten (SOLVD-T-Studie, absolute Risikoreduktion [ARR]: 4,5% [5, 10]), Betablocker um 34% (CIBIS-II-Studie, ARR: 5,5% [11]), MRA um 30% (RALES-Studie, ARR: 11,0% [12]) und ARB um 17% (CHARM-Alternative-Studie, ARR: 3,0% [13]). Dennoch ist vor allem eine unbehandelte HI nach wie vor mit einer sehr schlechten Prognose behaftet: Sie ist tatsächlich ungünstiger als jene mancher Krebsarten. [14] Das Mortalitätsrisiko hängt allerdings stark vom Schweregrad der HI ab, was sich auch darin ausdrückt, dass Hospitalisierungen wegen HI ein prognostisch ungünstiger Faktor sind. [15]
Therapie der Herzinsuffizienz
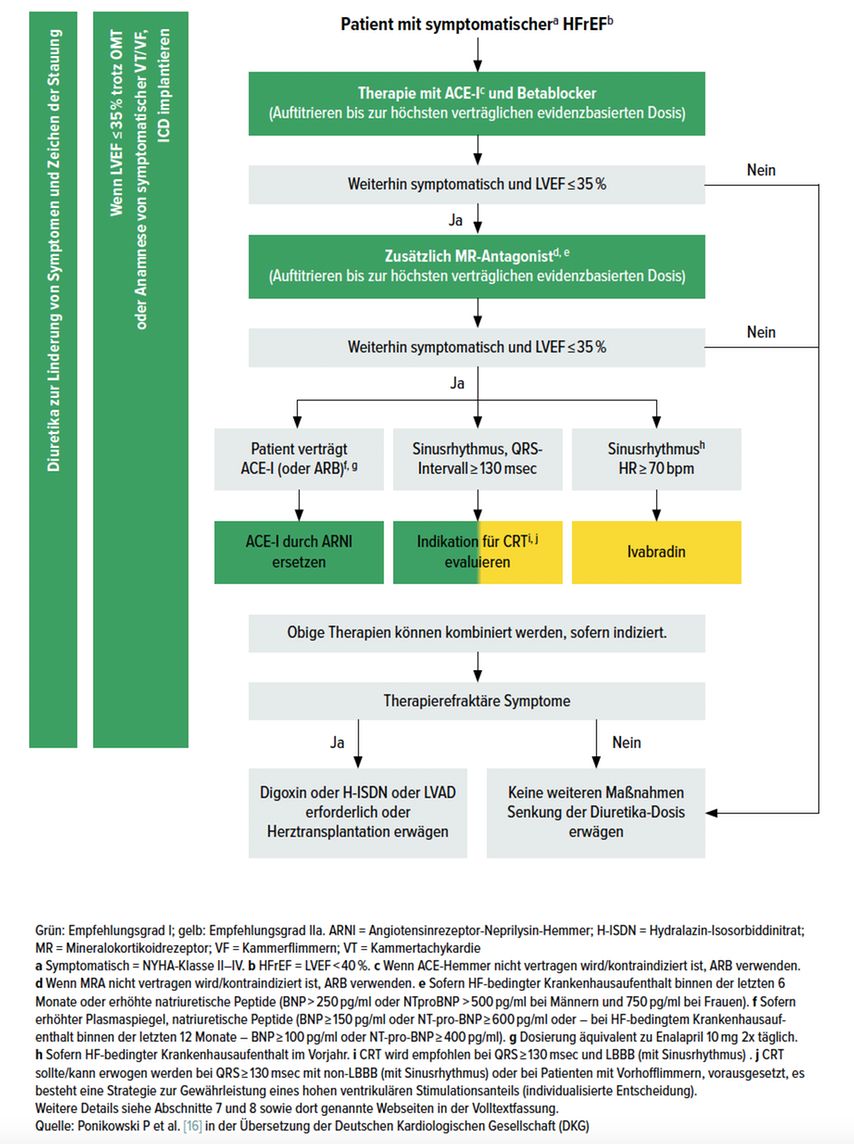
Neben der medikamentösen Therapie stellen Lebensstilmaßnahmen, die medizinische Trainingstherapie sowie in Abhängigkeit von der Ätiologie interventionelle Verfahren (Devices, z.B. spezielle Schrittmachersysteme) wesentliche Behandlungssäulen dar, auf die hier nicht näher eingegangen werden kann. Abbildung 3 auf der folgenden Seite zeigt den Überblicksalgorithmus für die Therapie der HFrEF aus den nach wie vor gültigen ESC-Leitlinien 2016.[16•]
Abb. 3: Behandlungsalgorithmus für Patienten mit symptomatischer Herzinsuffizienz mit reduzierter Ejektionsfraktion
An erster Stelle stehen in der medikamentösen Behandlung, folgend den pathophysiologischen Mechanismen, die Blockade des RAAS und des SNS. Dazu kommen, je nach klinischem Bedarf der Patienten, Diuretika als rein symptomatische Therapie ohne nachgewiesenen Effekt auf die Prognose der HI.
Sind ACE-Hemmer und Betablocker aufdosiert, ist der nächste Guideline-konforme Schritt, wenn ein Patient weiter symptomatisch ist und die LVEF ≤35% beträgt, die zusätzliche Verabreichung von MRA. Wenn auch unter der Dreierkombination Betablocker/RAAS-Inhibitoren/MRA weiterhin Symptomatik und LVEF ≤35% vorliegen, gibt es mehrere Möglichkeiten. So kann ein ACE-Hemmer bzw. ARB durch einen ARNI (Angiotensin-Rezeptor-Neprilysin-Inhibitor) ersetzt werden. Wenn ein verbreiterter Kammerkomplex (QRS-Dauer ≥130ms) besteht, sollte die Indikation für eine kardiale Resynchronisationstherapie geprüft werden. Besteht ein Sinusrhythmus mit einer Ruhefrequenz ≥70/min, kann der If-Kanal-Blocker Ivabradin verabreicht werden. Diese therapeutischen Optionen können, je nach individueller Situation, auch kombiniert werden.[16•]
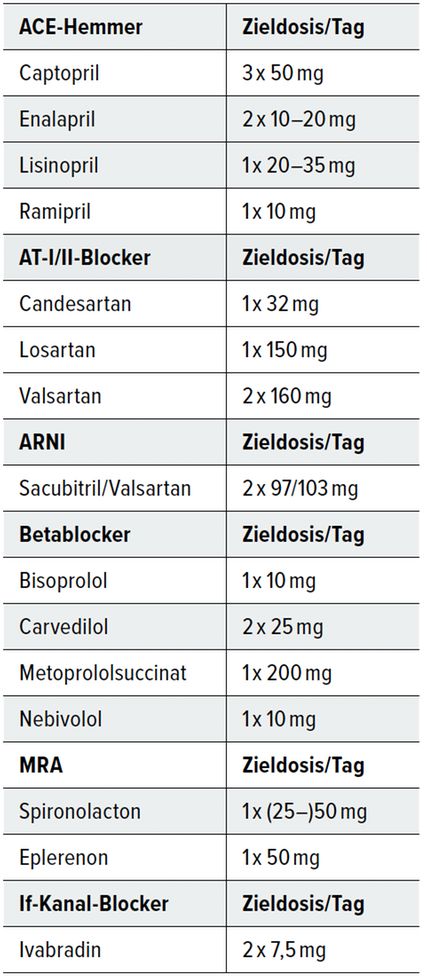
Ein immer wiederkehrendes Thema ist die Auftitrierung der verschiedenen bei HI empfohlenen Medikamente bis zu den Zieldosen, die in der Praxis oft nicht leicht erreicht werden. Hier ist ein geduldiges, aber konsequentes Auftitrieren bis zu einer Zieldosis notwendig, die der Patient verträgt (individuelles Optimum). Tabelle 1 zeigt die empfohlenen Zieldosen.
Tatsächlich ist eine optimierte Therapie der HI nicht so leicht zu erreichen bzw. zu erhalten; einerseits wegen der Problematik des Auftitrierens – oft müssen Dosisreduktionen wegen Blutdruckabfällen zum Beispiel im Rahmen von Infekten erfolgen –, andererseits wegen der teils fehlenden Wahrnehmung der HI als schwere Erkrankung vonseiten vieler Patienten. So haben 86% zwar von HI gehört, aber nur 3% können ihre Zeichen und Symptome beschreiben. 70% glauben nicht, dass es sich dabei um eine ernste bzw. schwere Erkrankung handelt, und 67% wissen nicht, dass HI-Patienten eine schlechtere Prognose haben als viele Krebspatienten. Dies wirkt sich auf die Medikamentenadhärenz aus.
Der Weg in Richtung einer optimalen Dosierung der HI-Medikamente kann also durchaus schwierig sein. Hier ist es oft sinnvoll, die Patienten in einem starren Schema wiederholt zu bestellen, um die entsprechenden Aufdosierungsschritte durchführen zu können. Dazu können auch regelmäßige telefonische Kontaktaufnahmen oder eine andere telemonitorische Unterstützung (siehe unten) hilfreich und sinnvoll sein.Dass solche strukturierten Disease-Management-Programme, wie sie auch die ESC empfiehlt, [17] die Mortalität durch HI reduzieren, ist inzwischen nachgewiesen.
Fall 1
Frau B. S. ist 70 Jahre alt und kommt wegen seit fünf Wochen bestehenden thorakalen Stechens sowie Leistungseinbuße, Müdigkeit und wiederholter Infekte zur kardialen Begutachtung. Ein schlecht eingestellter Typ-2-Diabetes ist bekannt (HbA1c zuletzt 10,4%!). Weiters bestehen Adipositas, Hypercholesterinämie, arterielle Hypertonie mit St. p. zahlreichen Entgleisungen, Steatosis hepatis und eine substituierte Hypothyreose.
Sie nimmt folgende Medikamente:

Die Compliance der Patientin ist verbesserungswürdig – so ist beim Erstkontakt nicht klar, welche dieser Medikamente sie wie regelmäßig tatsächlich einnimmt. Im EKG zeigt sie einen überdrehten Linkstyp mit Q-Zacken in V1–V3 und negativen T-Wellen in I und aVL, in der Echokardiografie eine reduzierte linksventrikuläre Funktion sowie eine Wandbewegungsstörung im distalen intraventrikulären Septum und im apikalen Bereich, weit über die Spitze reichend, als Hinweis auf eine Durchblutungsstörung im Bereich der LAD. Die LVEF liegt bei ca. 30%.
Die Patientin wird stationär aufgenommen, ein subakuter Myokardinfarkt bestätigt sich. Es besteht eine KHK (Zweigefäßerkrankung, proximale LAD, CX), es erfolgen eine PCI und Versorgung mit „drug-eluting stents“. Insgesamt besteht eine HFrEF auf Boden einer ischämischen Kardiomyopathie mit reduzierter LVEF.
Vor der Entlassung aus dem Krankenhaus zeigt das EKG weiterhin einen Sinusrhythmus mit einer Frequenz von 89/min, überdrehtem Linkstyp, Q in V1–3 mit leicht erhöhtem ST-Abgang. Der Blutdruck beträgt 115/65mmHg. Demnächst ist eine stationäre Phase-II-Rehabilitation geplant. Die Medikation bei Entlassung sieht folgendermaßen aus:

Bis sechs Wochen nach Erstkontakt wird der ACE-Hemmer bereits auf 10mg aufdosiert und 2x 5mg Ivabradin werden dazugegeben, weil sich die Aufdosierung des Betablockers wegen symptomatischer Hypotonie als schwierig erwiesen hat.
Trotzdem kommt es zwei Wochen später zu einer erneuten latenten kardialen Dekompensation mit Beinödemen, Stadium NYHA III. Der Blutdruck beträgt bei Kontrolle 130/85mmHg, die HF 81/min, im EKG Sinusrhythmus. Labor: Hb 12,3g/dl; Cr 0,8mg/dl; eGFR 71ml/min; Na 142mmol/l; K 3,4mmol/l;, Cl 98mmol/l.
Es wird das Schleifendiuretikum Furosemid passager einmal täglich verabreicht, und die Patientin erhält zusätzlich neu Eplerenon einmal täglich. Nach Rekompensation kann im Rahmen der stationären Rehabilitation der Betablocker doch aufdosiert werden, Ivabradin wird maximal gesteigert.
Nach der stationären Rehabilitation sieht die Medikation so aus:

Der klinische Zustand der Patientin hat sich nun deutlich gebessert.
Rehospitalisierungen
Daten haben gezeigt, dass die Anzahl der Hospitalisierungen wegen HI per se ein starker Mortalitätsprädiktor ist. So lag in einer Kohorte von 14374 HI-Patienten die mediane Überlebenszeit nach der ersten Hospitalisierung bei 2,4 Jahren; sie nahm mit jeder weiteren Hospitalisierung ab und betrug nach der vierten nur noch 0,6 Jahre (Abb. 4). [18]

Abb. 4: Hospitalisierungen und MortalitätGültig bis03/2024
Dabei wird die Zeit von einer Hospitalisierung zur nächsten immer kürzer. Nach der dritten Hospitalisierung stirbt die Hälfte der Patienten innerhalb eines Jahres.[18]
Der Grund dafür dürfte vor allem in der Tatsache bestehen, dass jedes akute Ereignis im Rahmen einer HI, das zu einer stationären Aufnahme führt, einen Myokardschaden verursacht, der nur mehr teilreversibel ist, somit die linksventrikuläre Dysfunktion progredient verschlechtert und die Mortalität steigert. [19]
Überlegen Sie: Was sind die drei hauptsächlichen Medikamentenklassen, die bei HFrEF zunächst gegeben werden? In welcher Reihenfolge soll das geschehen?
Zunächst werden ACE-Hemmer und bestimmte Betablocker verabreicht, dann, sofern immer noch Symptome und eine LVEF ≤35% bestehen, MRA.
Telemedizinische Betreuung
Neben der direkten Betreuung in Ordinationen und Ambulanzen kann – nicht nur in Pandemiezeiten – die telemedizinische Betreuung in verschiedenen Modellen einen wesentlichen Beitrag in der Betreuung von Patienten mit HI leisten. Die Bandbreite beginnt mit Telemonitoring, also Fernüberwachung übermittelter Daten, und geht weiter zu Modellen wie Teleassistance, Teleconsulting oder Telenursing.[20]Die Bedeutung des menschlichen Faktors im Rahmen solcher Betreuungsmodelle sollte jedoch nicht vernachlässigt werden.
Auch das Entlassungsmanagement nach einer HI-Hospitalisierung ist von größter Wichtigkeit. Im Unterschied zu vielen anderen Erkrankungen soll hier nach Möglichkeit die Therapie bei Stabilität verändert (hochdosiert) werden und noch der nächste Guideline-konforme Aufdosierungsschritt erfolgen. Hier gibt es einige Parameter, die zu beachten sind bzw. die aktuellen Möglichkeiten vorgeben (Tab. 2).[21]
Das Fallbeispiel 1 soll einen typischen Patientenverlauf bei HI illustrieren.

Tab. 2: Relevante Parameter
Devices
Die zwei Typen von kardialen Devices, die derzeit am häufigsten implantiert werden, sind implantierbare Cardioverter/Defibrillatoren (ICD) und Devices zur kardialen Resynchronisationstherapie (CRT).Ein ICD hat im Wesentlichen eine Überwachungsfunktion und kann im Bedarfs- bzw. Notfall, nach genau definierten Protokollen, Rhythmusstörungen terminieren oder auch einen elektrischen Impuls im Sinne einer Defibrillation auslösen.
Ein CRT-Device hingegen soll, im Gegensatz zum klassischen Schrittmachersystem, eine synchrone, typischerweise biventrikuläre Stimulation ausüben, um eine Asynchronie auszugleichen.
Es gibt die Kombination beider Geräte. Dabei sollten bei primärer ICD-Indikation alle Patienten mit reduzierter LVEF ≤35% und Asynchronie auch einen CRT erhalten, umgekehrt sind bei primärer CRT-Indikation und LVEF ≤35% die Patienten auch ICD-Kandidaten. Eine Ausnahme besteht dann, wenn der ICD keinen prognostischen Zusatznutzen bringt, etwa wegen weit fortgeschrittenen Alters und/oder erheblicher Komorbiditäten; hier ist ein CRT allein als symptomatische Maßnahme indiziert.
Trainingstherapie
Die kardiale Dysfunktion führt über eine Fülle von Mechanismen, die letztlich in Belastungsdyspnoe und eingeschränkter Belastbarkeit münden, dazu, dass HI-Patienten sich körperlich schonen, was zu weiterer Schwächung führt.[22] Die ESC-Leitlinien empfehlen Trainingstherapie mit dem Empfehlungsgrad IA. Körperliches Training bei HI ist sicher, es verbessert die Symptomatik und die funktionelle Kapazität und reduziert das Risiko für Hospitalisierungen. Eine Mortalitätsreduktion durch körperliches Training allein ist nicht nachgewiesen; das Training sollte Teil eines multidisziplinären HI-Managementprogramms sein.[16•] Aufgrund der verminderten funktionellen Kapazität und teilweise auch des höheren Patientenalters bedeutet Trainingstherapie bei HI-Patienten einen vermehrten Betreuungsaufwand. Die medikamentöse Therapie muss laufend angepasst werden; auf Zeichen der Notwendigkeit eines Trainingsabbruchs muss geachtet werden; die Reaktion auf das Training ist zu evaluieren. Häufige Probleme sind Hypotonie, kardiale Arrhythmien, Probleme mit dem Flüssigkeitshaushalt, Dyspnoe und Müdigkeit.
Neuere medikamentöse Ansätze
Es gibt eine Reihe von neueren therapeutischen Ansatzpunkten. Für HFrEF wurde z.B. mit Dapagliflozin, auch ohne Diagnose eines Diabetes mellitus, eine Verbesserung des Gesundheitsstatus der Patienten erreicht, während der IL-1-β-Antikörper Canakinumab die Zahl der Hospitalisierungen senkte. Bei HFpEF gibt es weiterhin keine signifikant die Prognose bessernde medikamentöse Therapieoption. Es wurden mit Spironolacton Verbesserungen der diastolischen Funktion erreicht.
Herzinsuffizienz und Covid-19
Im Zuge schwerer Covid-19-Erkrankungen kommt es auch (abgeleitet von Biomarker-Messungen) zu einer hohen Prävalenz an subklinischen Myokardschädigungen. Bisherige klinische Daten zeigen keinen Anhaltspunkt für erhöhte Inzidenz von Covid-19 bei Patienten unter RAAS-Blocker-Therapie, von einem Absetzen wird daher abgeraten. Im Rahmen des ersten Lockdowns im Frühjahr 2020 kam es zu einem Rückgang an Hospitalisierungen aufgrund akuter HI, die hospitalisierten Patienten hatten jedoch schwere Symptome und längere stationäre Aufenthalte. Eine Hospitalisierung von HI-Patienten sollte bei entsprechender Indikation auch während der Covid-19-Pandemie nicht verzögert werden.
Polypharmazie bei HI – Wechselwirkungen von Arzneimitteln
Die Tendenz zur Polypharmazie, gerade bei älteren und multimorbiden Patienten, steigt und die Folgen sind schwer kalkulierbar.[23] Die Definition von Polypharmazie lautet „gleichzeitige und andauernde Einnahme mehrerer Wirkstoffe“, wobei nicht einheitlich definiert ist, ab welcher Anzahl von Polypharmazie gesprochen wird und ob „Over the counter“-Medikamente sowie sogenannte potenziell inadäquate Medikamente dazugezählt werden oder nicht. Häufig wird die Polypharmazie als Einnahme von mehr als fünf Wirkstoffen definiert. In Deutschland nehmen etwa zwei Drittel aller Patienten über 65 Jahre mehr als fünf verschiedene Arzneimittel ein, wovon etwa 25% als potenziell inadäquat zu betrachten sind (Tab. 3).

Tab. 3: Ursachen von Polypharmazie
Natürlich soll nicht nur die Quantität, sondern vor allem auch die Qualität einer Arzneimitteltherapie beurteilt werden. Als angemessen gilt eine solche Therapie dann, wenn sie therapeutisch notwendig und sinnvoll ist. Eine unangemessene Arzneimitteltherapie stellt hingegen für die Patienten insgesamt mehr Risiko als Nutzen dar und umfasst im Wesentlichen die Verordnung von klinisch nicht indizierten Arzneimitteln („overprescribing“), das Vorenthalten notwendiger Arzneimittel („underprescribing“) sowie eine suboptimale Therapie in Bezug auf Dosis, Interaktionspotenzial und Therapiedauer („misprescribing“).[24] Eine typische Polypharmazie zeigt der Fall 2.Klinisch relevante Entgleisungen bei HI können z.B. Elektrolytstörungen, Orthostase, Herzrhythmusstörungen, hypertensive Krisen oder Nierenversagen sein.
Medikamente, die bei Herzinsuffizienz zu vermeiden sind
Es gibt laut den HI-Leitlinien 2016 bei HI einige Medikamente, die besser vermieden werden sollten. Dazu zählen Glitazone (derzeit nur Pioglitazon verfügbar), weil sie das Risiko für eine HI-Verschlechterung und -Hospitalisierung erhöhen. Das Gleiche gilt auch für NSAR, einschließlich COX-2-Hemmern, und für Diltiazem und Verapamil. Ein Angiotensin-Rezeptor-Blocker (ARB oder Sartan) mit einem ACE-Hemmer bzw. mit der Kombination ACE-Hemmer/MRA wird nicht empfohlen, weil dadurch das Risiko für eine Niereninsuffizienz und eine Hyperkaliämie ansteigt. [16•]
Diuretika werden, wie erwähnt, zwar bei HI empfohlen, der Einsatz von Thiaziden in der Dauertherapie ist jedoch wegen Verschlechterung der Nierenfunktion kritisch zu sehen.
Überlegen Sie: Welche Hauptrisiken würden sich bei einer (zu vermeidenden) Kombination von Angiotensin-Rezeptor-Blockern und ACE-Hemmern bei HI-Patienten ergeben?
Das Risiko für eine Niereninsuffizienz und für eine Hyperkaliämie steigt an.
Fall 2
Herr B. R. ist 81 Jahre alt und leidet an einer hochgradigen HI (HFrEF, LVEF 25%), Schrittmacher, St. p. Mitralklappenrekonstruktion; chronische Niereninsuffizienz, KHK, 2018 akutes Koronarsyndrom, konservativ behandelt; St. p. aortokoronarem Bypass 1995; rezidivierende Elektrolytentgleisungen, schwankender Blutdruck; St. p. Prostatakarzinom mit Brachytherapie 2002; Adipositas.
Labor: Hb12 g/dl, Cr 2,3mg/dl, eGFR 27ml/min, BNP: 1214pg/ml.
Der Patient nimmt derzeit folgende Medikamente:

Für jedes einzelne dieser Medikamente lässt sich zwar eine Begründung anführen; dennoch liegt hier der klassische Fall einer massiven Polypharmazie vor.
Die Frage, die sich bei diesem Patienten stellte, war, ob es möglich ist, ihm – durchaus leitlinienkonform – anstelle des ACE-Hemmers Sacubitril/Valsartan zu verabreichen.
Doch bereits vor der Entscheidung über eine mögliche Umstellung zeigt die Analyse der angeführten Medikamentenliste eine Reihe von Problemen. So kann es durch die Kombination von Fentanyl, Fluoxetin und Risperidon zu einem Serotonin-Syndrom kommen. Eplerenon ist bei einer GFR unter 30ml/min kontraindiziert. Aufgrund der reduzierten Nierenfunktion sollte auch Enalapril in diesem Fall in der Dosis reduziert werden. Die Kombination von Xipamid und Furosemid kann zu Hypokaliämie führen. Der Benefit einer in der täglichen Kombination sollte hier hinterfragt werden. Risperidon und Pramipexol vertragen sich wegen eines pharmakodynamischen Antagonismus nicht (gegenläufige Wirkung auf das Dopaminsystem).
Grundsätzlich ist die Gabe von Sacubitril/Valsartan bei diesem Patienten möglich, sofern die Nierenfunktion verbessert werden kann. Allerdings müsste der ACE-Hemmer Enalapril 36 Stunden vorher abgesetzt werden. Die Startdosis würde 24/26mg 2x/Tag betragen. Auf Hypotonie bzw. Orthostase wäre zu achten.
Pharmakodynamische Interaktionen
Hier gibt es viele Möglichkeiten, die folgenden Beispiele sind bei HI besonders relevant.
Die SGLT2-Hemmer Empagliflozin und Dapagliflozin werden bei Typ-2-Diabetikern mit HI eingesetzt. Sie führen zu einer verstärkten Diurese, weshalb die gleichzeitige Gabe von Diuretika problematisch sein kann (Elektrolytstörungen, Hyponatriämie). Bei zusätzlicher Gabe von Sulfonylharnstoffen oder Insulin kann es zu Hypoglykämien kommen. Bei HI und Typ-2-Diabetes kann es unter SGLT2-Hemmern auch zur euglykämischen Ketoazidose kommen. Unter Canagliflozin ist es zu einer erhöhten Rate an Amputationen im Bereich der unteren Extremitäten gekommen. Eine sehr seltene, aber schwere Nebenwirkung von SGLT2-Hemmern ist die nekrotisierende Fasziitis (Fournier-Gangrän).
Eine Hyponatriämie kann durch eine Reihe verschiedener Medikamentenklassen verursacht werden, zunächst durch RAAS-Blocker, weiters auch durch Diuretika (Thiazide, Schleifendiuretika, Amilorid). Verschiedene Medikamente wie Antidepressiva, Antipsychotika, Antikonvulsiva, Lithium, Thiazide, Antiarrhythmika, NSAR, Benzodiazepine und Vasopressin-Analoga verursachen eine inadäquate ADH-Sekretion, was ebenfalls zum Natriumverlust führt. Schließlich kann es durch gastrointestinale Nebenwirkungen verschiedenster Medikamente wie Erbrechen und Durchfall zum Elektrolytverlust kommen. Hoch dosiert können auch Protonenpumpenhemmer zu Natriumdefiziten führen.
Andere wesentliche Medikamenteninteraktionen können zu Hyperkaliämie, QT-Zeit-Verlängerung oder orthostatischer Hypotonie führen.
Pharmakokinetische Interaktionen
Dieser Typ von Interaktionen kann z.B. entstehen, wenn Medikamente die Expression von Enzymen des Cytochrom-P-450-Systems in der Leber beeinflussen. Durch Hemmung von CYP-Enzymen kommt es zum Anstieg, durch Induktion zum Abfall des Plasmaspiegels.
So sind z.B. manche Makrolide wie Erythromycin oder Clarithromycin, Azol-Antimykotika, Amiodaron, Verapamil, Diltiazem, Fluvoxamin oder Fluoxetin Inhibitoren von CYP3A4, während Rifampicin, aber auch Barbiturate, Carbamazepin, Phenytoin oder Johanniskraut dieses Enzym induzieren. Substrate von CYP3A4 sind u.a. Benzodiazepine, bestimmte Statine, manche Antidepressiva, Fentanyl, Paracetamol, Kumarine, Sildenafil, Theophyllin und Azole.
Aber auch Grapefruitsaft inhibiert CYP3A4 und kann z.B. die Plasmaspiegel von Ivabradin verdoppeln. Dadurch besteht ein höheres Risiko für Sehbehinderungen, Bradykardien und Kopfschmerzen. Auch bei Verwendung von NOAK sind die entsprechenden Medikamenteninteraktionen zu beachten. [25]
Da die Niere das Ausscheidungsorgan der meisten Arzneimittel ist, ist eine regelmäßige Überprüfung der Nierenfunktion bei Polypharmazie notwendig. Eine praktische Hilfe, speziell zur Dosierung bei Niereninsuffizienz, findet sich auf der Website www.dosing.de.
Zusammenfassung zur Polypharmazie bei Herzinsuffizienz
Herzinsuffizienzpatienten sind sehr oft Patienten mit Polypharmazie. Eine regelmäßige Überprüfung der Nierenfunktion und der verordneten Arzneimittel ist für eine optimale medikamentöse Therapie unter Vermeidung von klinisch relevanten Arzneimittelinteraktionen essenziell. Eine umfassende rezente Darstellung der möglichen Therapieoptionen bei HI mit dem Schwerpunkt auf Neben- und Wechselwirkungen bietet die Nationale VersorgungsLeitlinie Chronische Herzinsuffizienz – Langfassung der Bundesärztekammer (BÄK), der kassenärztlichen Bundesvereinigung (KBV) und der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF). [26••]
Zusammenfassung der in diesem med·Diplom vermittelten Lerninhalte
Die Therapie und die Betreuung von Patienten mit Herzinsuffizienz müssen im Rahmen eines Gesamtkonzeptes erfolgen, dessen wichtigste Punkte in dieser Fortbildung vorgestellt wurden (Teil 1). Sowohl Epidemiologie als auch Pathophysiologie der Entwicklung der HI werden kurz behandelt, ebenso Mortalität und Prognose.
Von besonderer Wichtigkeit ist die medikamentöse Therapie, für die es einen klaren Algorithmus in den nach wie vor gültigen ESC-Leitlinien von 2016 gibt. Auch die Möglichkeiten der telemedizinischen Betreuung und die Trainingstherapie werden angesprochen.
Im zweiten Teil geht es um die Problematik der Polypharmazie mit besonderem Fokus auf Probleme bei HI.
Klinische Relevanz
Im Gegensatz zu anderen Herzerkrankungen steigt die Häufigkeit der HI an, was u. a. mit dem Älterwerden der Bevölkerung zu tun hat. Die HI hat nach wie vor eine Prognose, die schlechter ist als jene mancher Krebserkrankungen. Deshalb ist nicht nur die Betreuung von HI-Patienten im Krankenhaus wichtig, sondern vor allem auch ein korrektes Entlassungs- und Schnittstellenmanagement – dies auch im Hinblick auf die Thematik der Polypharmazie, auf die besonderes Augenmerk gelegt werden sollte.
Das sollten Sie lesen:
Die Autoren empfehlen folgende Referenzen als wissenschaftlich und/oder praktisch besonders relevant
(im Text und in der Literaturliste markiert mit • und ••).
[16] Ponikowski P et al.:
2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure
Hier finden Sie Detailempfehlungen und Hintergrundreferenzen für jegliche diagnostische und therapeutische Entscheidung im Umgang mit Patienten mit Herzinsuffzienz.
[26••] BÄK, KBV, AWMF:
Nationale VersorgungsLeitlinie Chronische Herzinsuffizienz – Langfassung
Die Leitlinie bietet eine umfassende rezente Darstellung der möglichen Therapieoptionen bei HI mit dem Schwerpunkt auf Neben- und Wechselwirkungen.
Literatur
[1] Sandri M et al.: Das vaskuläre Endothel als Zielorgan körperlicher Aktivität. Journal für Kardiologie 2009; 16(7-8): 280-3 [2] Mcmurray JJ: Clinical practice. Systolic heart failure. N Engl J Med 2010; 362(3): 228-38 [3] Francis GS et al.: The neurohumoral axis in congestive heart failure. Ann Intern Med 1984; 101(3): 370-7
[4] Krum H, Abraham WT: Heart failure. Lancet 2009; 373(9667): 941-55 [5] Mcmurray JJ et al.: ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur Heart J 2012; 33(14): 1787-847 [6] Levin ER et al.: Natriuretic peptides. N Engl J Med 1998; 339(5): 321-8 [7] Nathisuwan S, Talbert RL: A review of vasopeptidase inhibitors: a new modality in the treatment of hypertension and chronic heart failure. Pharmacotherapy 2002; [8] Kemp CD, Conte JV: The pathophysiology of heart failure. Cardiovasc Pathol 2012; 21(5): 365-71 [9] Schrier RW, Abraham WT: Hormones and hemodynamics in heart failure. N Engl J Med 1999; 341(8): 577-85 [10] Yusuf S et al.: Effect of enalapril on survival in patients with reduced left ventricular ejection fractions and congestive heart failure. N Engl J Med 1991; 325(5): 293-302
[11] CIBIS-II Investigators and Committees: The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): a randomised trial. Lancet 1999; 353(9146): 9-13 [12] Pitt B et al.: The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators. N Engl J Med 1999; 341(10): 709-17 [13] Granger CB et al.: Effects of candesartan in patients with chronic heart failure and reduced left-ventricular systolic function intolerant to angiotensin-converting-enzyme inhibitors: the CHARM-Alternative trial. Lancet 2003; 362(9386): 772-6 [14] Stewart S et al.: More 'malignant' than cancer? Five-year survival following a first admission for heart failure. Eur J Heart Fail 2001; 3(3): 315-22 [15] Curtis LH et al.: Early and long-term outcomes of heart failure in elderly persons, 2001-2005. Arch Intern Med 2008; 168(22): 2481-8 [16•] Ponikowski P et al.: 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2016; 37(27): 2129-200 [17] Mcdonagh TA et al.: Heart Failure Association of the European Society of Cardiology Specialist Heart Failure Curriculum. Eur J Heart Failure 2014; 16(2): 151-62 [18] Setoguchi S et al.: Repeated hospitalizations predict mortality in the community population with heart failure. Am Heart J 2007; 154(2): 260-6 [19] Gheorghiade M et al.: Pathophysiologic targets in the early phase of acute heart failure syndromes. Am J Cardiol 2005; 96(6a): 11g-17g [20] Haass M, Störk S: Therapiemonitoring bei chronischer Herzinsuffizienz mittels BNP und NT-proBNP. Kardiologie up2date 2012; 08(01): 10-5 [21] Wieser M: Entlassungsmanagement bei Patienten mit Herzinsuffizienz: Der optimale nächste Schritt. Journal für Kardiologie 2016; 23(5-6): 162-3 [22] Wonisch M et al.: Aktuelle Evidenz von körperlichem Training bei Herzinsuffizienz – ist Sport das bessere Medikament? Journal für Kardiologie 2004; 11(11): 441-5 [23] Moßhammer D et al.: Polypharmacy-an upward trend with unpredictable effects. Dtsch Arztebl Int 2016; 113(38): 627-33 [24] Gesundheit.gv.at: Polypharmazie. https://www.gesundheit.gv.at/lexikon/p/lexikon-polypharmazie. Zuletzt aufgerufen: 2020/10/25 [25] Steffel J et al.: The 2018 European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist oral anticoagulants in patients with atrial fibrillation. Eur Heart J 2018; 39(16): 1330-93 [26••] Bundesärztekammer (BÄK), Kassenärztliche Bundesvereinigung (KBV), Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF). Nationale VersorgungsLeitlinie Chronische Herzinsuffizienz – Langfassung, 3. Auflage. Version 2. 2019 [zitiert: 2021-01-08]. DOI: 10.6101/AZQ/000467